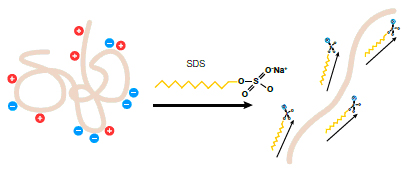
مواد لازم جهت انجام SDS-PAGE
- محلول استوک اکریل آمید (۳۰.۸ درصد): ۳۰ گرم آکریل آمید و ۰.۸ گرم بیس اکریل آمید را زیر هود وزن کنید و در آب مقطر تا حجم نهایی ۱۰۰ میلی لیتر حل نمایید. محلول را با کاغذ واتمن شماره ۱ صاف کنید و در ظرف تیره بریزید. این محلول تا ۳ ماه در یخچال قابل استفاده است.
نکته: از استنشاق پودر اکریل آمید و بیس اکریل آمید در هنگام توزین و تماس با محلول آنها خودداری نمایید.
- بافر ژل پایین:۱۸.۲ گرم تریس باز و ۰.۴ گرم SDS را در ۷۰ میلی لیتر آب مقطر حل نمایید. PH محلول را با اسید کلریدریک ۲ مولار به ۸.۸ برسانید. سپس آب مقطر تا حجم نهایی ۱۰۰ میلی لیتر اضافه کنید. غلظت تریس در این بافر ۱.۵ مولار است.
- بافر ژل بالا:۶.۱ گرم تریس باز و ۰.۴ گرم SDS را در ۵۰ میلی لیتر آب مقطر حل نمایید. با اسید کلریدریک ۲ مولار PH آن را به ۶.۸ برسانید. سپس آب مقطر تا حجم نهایی ۱۰۰ میلی لیتر اضافه کنید. غلظت تریس در این بافر ۰.۵ مولار است.
- بافر الکترود (بافر مخازن):۳ گرم تریس باز، ۱۴.۴ گرم گلیسین و ۱ گرم SDS را در ۱ لیتر آب مقطر حل کنید، PH این بافر حدود ۸.۳ می باشد و نیاز به تنظیم ندارد.
- بافر نمونه (۵X): 10 میلی لیتر بافر ژل بالا، ۵ میلی لیتر گلیسرول، ۱ گرم SDS، ۰.۲ میلی لیتر محلول بروموفنلبلو (۰.۵ درصد در اتانول) و ۱ میلی لیتر ۲-مرکاپتواتانول را در یک ظرف مخلوط نمایید. سپس با آب مقطر به حجم نمایی ۲۰ میلی لیتر برسانید.
- پرسولفات آمونیوم ۱۰ درصد: ۱/۰ گرم پرسولفات آمونیوم در ۱ میلی لیتر آب مقطر حل کنید. این محلول باید تازه تهیه شود.
- TEMED 10 درصد:۱/۰ میلی لیتر TEMED در ۹/۰ میلی لیتر آب مقطر حل کنید. این محلول باید به صورت تازه تهیه شود.
- مارکرهای وزن مولکولی نیز آماده باشند.
انجام آزمایش SDS PAGE
- ابتدا قبل از انجام هر گونه آزمایش، پلیت ها، اسپیسرها و شانه ها را در یک دترجنت آزمایشگاهی شسته. دقت شود که از مواد خورنده جهت شستوشو استفاده نشود. در صورتی که ژل برای مراحل بعد مانند رنگ آمیزی با نقره مورد نیاز باشد، توصیه می شود که شیشه ها را به صورت شبانه در کرومیک اسید انکوبه نمایید و سپس با آب مقطر شسته و در نهایت با اتانول ، استون و اتانول به ترتیب شستوشو دهید. هیچگاه اجازه ندهید کرومیک اسید و یا حلال های آلی با ترکیبات پلاستیکی تماس داشته باشند. در نهایت شیشه ها را با دستان پوشیده شده با دستکش تمیز بردارید.
- سر هم کردن پلیت ها:
برای سر هم نمودن ابتدا شیشه مستطیل شکل را روی یک سطح کاملا صاف قرا دهید، سپس اسپیسرها را مطابق شکل روی آن قرار دهید (در مدلهای جدید اسپیسر به شیشه مستطیل چسبیده است و نیاز به قرار دادن آن روی شیشه ندارید)، سپس شیشه U-شکل را روی آن قرار دهید. در این مرحله دقت شود که هر دو شیشه روی هم به صورت کاملا تراز قرار دارند.
نحوه سر هم کرد شیشه ها
شکل ۱) نحوه سر هم کردن شیشه ها
- حالا شیشه های روی هم قرار گرفته را مطابق شکل زیر در دستگاه قرار داده. برای این کار تنها لازم است پیچ های دو طرف دستگاه را شل نمایید و شیشه ها را در آن قرار دهید. برای شیشه های سمت دیگر دستگاه نیز همین کار را تکرار نمایید.

مکانیسم عمل مرکاپتو اتانول
شکل ۲) گذاشتن ژل در دستگاه
- جهت تراز نمودن کامل مطابق شکل زیر با نوک انگشت بررسی شود که آیا شیشه ها کاملا به هم تراز هستند یا نه. در صورت تراز بودن شیشه ها با هم پیچ های دو طرف دستگاه را بسته تا شیشه ها جابجا نشوند. جهت اطمینان از عدم نشت دهی دستگاه، یک قطره کوچک وازلین در ته دستگاه به دو طرف شیشه ها (کنار اسپیرها) بزنید.
- حالا دستگاه را برداشته ومطابق شکل زیر روی تخته ژل قرار دهید و پیچ های تخته ژل را مطابق علامت روی آن سفت کنید. برای اطمینان از بسته شدن درست دستگاه، نشتی آن را با آب مقطر تست کنید.
ریختن ژل پایین (ژل جدا کننده) در SDS PAGE
محلول ژل پایین را از اجزای آن با توجه به درصد آن تهیه نمایید. نحوه تهیه ۱۲ میلی لیتر از محلول ژل پایین در جدول زیر آمده است.
تهیه ۱۲ میلی لیتر محول ژل پایین با غلظت های مختلف
اجزای ژل پایین به غیر از TEMED را در یک ظرف مناسب مخلوط نمایید. محلول را حدود ۳۰ ثانیه با پمپ خلا از هوا تخلیه کنید. سپس TEMED را اضافه کنید. پس از هم زدن سریع ، محلول را در بین شیشه ها تا ارتفاع مناسب بریزید. باید دقت شود که حدود ۳ سانتیمتر فضا برای ژل بالا لازم می باشد. حدود ۰.۵ میلی لیتر آب مقطر با سمپلر به آرامی از کنار شیشه روی سطح ژل بریزید، به نحوی که با ژل مخلوط نگردد. انعقاد ژل پایین معمولا ۱۵-۴۵ دقیقه طول می کشد. ژل منعقد شده به وضوح از آب مقطر روی آن (به دلیل تفاوت در ظریب شکست نور) قابل تشخیص می باشد.
تهیه ژل بالا (ژل متراکم کننده) SDS PAGE
بعد از انعقاد ژل پایین، مطابق جدول زیر ژل بالا را تهیه نمایید.
تهبه ۵ میلی لیتر محلول بالا با غلظت درصدهای ۳، ۴ ،۵
معمولا غلظت این ژل ۳، ۴ و یا ۵ ٪ است. اجزای ژل بالا غیر از TEMED را در ظرف مناسبی مخلوط کنید. آب روی ژل پایین را کاملا خالی کنید. برای حذف قطرات باقیمانده آب، حدود ۱ میلی لیتر محلول ژل بالا را در جدار داخلی شیشه بگردانید و مجددا تخلیه نمایید. به بقیه محلول ژل بالا TEMED اضافه نمایید و پس از هم زدن سریعا تا ارتفاع مناسب روی ژل پایین بریزید سپس شانه را با دقت در ژل بالا فرو کنید، به طوری که دندانه های آن حدود ۱.۵ سانتیمتر از سطح ژل فاصله داشته باشند. معمولا ژل بالا در کمتر از ۱۵ دقیقه می بندد (کناره دندانه های شانه از ژل منعقد شده قابل تشخیص است). بهتر است قبل از دو آوردن شانه ، انتهای دندانه آن را روی شیشه با ماژیک مشخص کنید تا نمونه گذاری و تشخیص چاهک ها راحت باشد.
آماده سازی جهت ران SDS PAGE
پس از بسته شدن ژل بالا، شانه ها را از آن خارج نموده و دستگاه را به دورن تانک قرار دهید. مخازن تانک و دستگاه را تا ارتفاع مناسب به ترتیب با بافر الکترود و بافر نمونه پر کنید. هر گونه حباب در انتهای ژل را با تزریق بافر توسط سرنگ خارج نمایید.
افزودن نمونه ها:
یک حجم بافر نمونه (۵ X) را به ۴ حجم نمونه پروتئین اضافه نمایید. اگر پروتئین به صورت پودر است، مقدار مورد نیاز آن را در بافر نمونه که ۵ بار با آب مقطر رقیق شده (بافر ۱ X) ، حل کنید. نمونه و بافر نمونه را در یک ظرف کوچک درب دار ریخته و به مدت ۵ دقیقه در ظرف آب جوش قرار دهید. در صورت کدورت نمونه و یا وجود ذرات نامحلول، آن را به مدت ۱۰ دقیقه در دور ۱۰/۰۰۰ g. سانتریفیوژ نمایید.سپس با سرنگ هامیلتون یا سمپلر مناسب ۱۰-۲۰ میکرولیتر از هر نمونه را به دقت در چاهک بریزید. به دلیل وجود گلیسرول، نمونه در ته چاهک قرار میگیرد. مقدار پروتئین موجود در هر چاهک به میزان خلوص نمونه و روش رنگ آمیزی بستگی دارد.
حالا سیم های رابط را به الکتروفورز وصل نمایید و برای الکتروفورز در جریان الکتریکی ثابت، شدت جریان ۲۰-۳۰ میلی آمپر را تنظیم نمایید. در این حالت رنگ نشانگر (بروموفنل بلو) طی مدت ۱.۵ تا ۲ ساعت به انتهای ژل می رسد.
پس از اتمام عمل الکتروفورز، جریان را قطع نمایید و دستگاه را از تانک بیرون آورید. سپس پیچ های آن را شل نمایید و شیشه های حاوی ژل را با دقت بردارید. با استفاده از کاردک همراه دستگاه به آرامی شیشه ها را از هم جدا کنید و ژل را برداشته. در صورت لزوم ژل را رنگ آمیزی کنید.
رنگ آمیزی
رنگ آمیزی پروتئین ها در ژل پلی اکریل آمید با روش های متنوعی امکان پذیر است. کوماسی بلو (انواع R و G)[1] و نقره از پر استفاده ترین مواد برای رنگ آمیزی پروتئین ها هستند. در اینجا رنگ آمیزی با کماسی بلو که بسیار متداول می باشد ، توضیح داده می شود.
رنگ آمیزی با کوماسی بلو R-250
کوماسی بلو R-250 معمولترین رنگ برای رنگ آمیزی پروتئین ها است. سادگی رنگ آمیزی، هزینه کم، ثبات رنگ برای مدت طولانی و حساسیت نسبتا بالا از مزایای آن می باشند. حساسیت این روش ۰.۵-۰.۲ میکروگرم پروتئین در هر باند می باشد. در این روش مراحل تثبیت و رنگ آمیزی پروتئین ها به طور همزمان صورت می گیرد.
شکل ۵) حمام رنگ جهت رنگ آمیزی پروتئین ها در ژل اکریل آمید.
مواد
- محلول رنگ آمیزی: ۰.۲۵ گرم کوماسب بلو R-250 را در ۱۲۵ میلی لیتر متانول حل کنید. سپس ۲۵ میلی لیتر اسید استیک گلاسیال و ۱۰۰ میلی لیتر آب مقطر اضافه نمایید. غلظت رنگ در این محلول حدود ۰.۱ درصد وزنی/حجمی است. قبل از استفاده محلول رنگ را با کاغذ واتمن شماره ۱ صاف کنید. این محلول می تواند به عنوان تثبیت کننده پروتئین ها نیز عمل کند.
- محلول رنگ بر: ۲۰۰ میلیلیتر متانول، ۱۰۰ میلی لیتر اسید استیک گلاسیال و ۷۰۰ میلی لیتر آب مقطر را به هم بیفزایید.
روش رنگ آمیزی
- ژل را در ظرف درب دار قرار دهید. حجم کافی از محلول رنگ (مثلا ۱۰۰ میلی لیتر برای یک ژل کوچک) اضافه کنید. در ظرف را بسته و آن ربا ۱-۲ ساعت روی شیکر قرار دهید. این مدت زمان برای رنگ آمیزی ژلی با غلظت ۱۰ ٪ و ضخامت پ میلی لیتر کافی است.
- محلول رنگ را تخلیه کنید. ژل را کاملا با آب معمولی شسته، سپس محلول رنگ بر اضافه کنید. در ظرف را بسته، آن را روی شیکر قرار دهید. پس از تیره شدن محلول رنگ بر، آن را با محلول تازه تعویض کنید. این عمل را چند بار تکرار کنید تا زمینه ژل شفاف گردد و باندهای پروتئینی به وضوح مشاهده شوند.
- ژل را در محلول ۷ درصد اسید استیک قرار دهیدو در ظرف را ببنیدید. ژل در این حالت برای مدت طولانی قابل نگهداری است.
تعیین وزن
در تکنیک SDS-PAGE مولکولهای پروتئینی با استفاده از سدیم دودسیل سولفات به صورت خطی در می آیند و حرکت آنها بر اساس وزن میباشد. همانگونه که پیش تر نیز ذکر شد، مسافت طی شده پروتئین ها با لگاریتم وزن مولکولی آنها رابطه خطی دارد. پس هرچه پروتئین بزرگتر باشد مسافت طی شده کمتر خواهد بود.
به طور معمول در زمان بارگیری نمونه ها، در یکی از چاهک ها مارکر پروتئینی نیز اضافه می کنند. مارکرهای پروتئینی متشکل از چندین پپتید با وزن مولکولی مشخص می باشند. با مقایسه نمودن میزان حرکت پروتئین مورد نظر بر روی ژل با مارکر های پروتئینی با استفاده از رسم نمودار حرکت نسبی می توان وزن مولکول هدف را تخمین زد.
شکل ۶) مارکر مورد استفاده در تکنیک SDS-PAGE به همراه پروتئین های مورد بررسی
دفتر مرکزی
کرج - بعد از پل آزادگان - ابتدای خیابان مطهری- نبش کوچه ساوجی - ساختمان کوروش پلاک 901 - طبقه اول واحد 1- کد پستی: 3149649837
تلفن های تماس
026-32555937 - 026-32555938
09363928058 - 09123050747
09120796671 - 09380626117
asadimohammadreza@yahoo.com
kalantari.ali67@gmail.com



.png)