Terminator:
ساختار آن در جلسه قبل توضیح داده شده است ( فاصله 10 نوکئوتیدی , حالت سنجاق سری, دم کوتاه پلی A ، پیوندهای سست و جدا شدن RNA m از DNA )
Ribosom bindiy site :
در پروکاریوتها شانگل بارلود (؟) است این ناحیه به Subunite کوچک ریبوزوم متصل شده ،پس از محل ِاتصال ، ناحیه کدون AUG قرار دارد که اسید آمینه متیونین ( اولین اسید آمینه هرزنجیره پروتئینی ) را کد می کند سپس روی RNA m حرکت کرده و تک تک, اسیدهای آمینه را اضافه می کند تا به کدونهای پایانی UAA یا UAG یا UGA برسد . در اینجا سیستم ریبوزم از زنجیره جدا شده و محصول ( زنجیره پلی پپتیدی ) را خواهیم داشت . .
Vectors and hostcells:
وکتورها با توجه به host ارزش و اعتبار پیدا می کنند . لذا با توجه به اینکه چه نوع از host در Gene cloning استفاده می شود نوع وکتور متفاوت می شود . در ساخت وکتور (پلاسمید مصنوعی حاوی قطعه ژنی مد نظر ) باید به پسوندها و پیشوندهایی که همراه قطعه ژنی (همان قطعه ای که می خواهیم کلون کنیم ) دقت شود; مثلاً اگر این قطعه ژنی مربوط به یوکاربوت است با حفظ همان پسوند و پیشوندهای یوکاریوتی اش در یک host پروکارویوتی و حتی host یوکاریوتی نمی تواند بیان شود چون در موجودات مختلف سیستم هایی مانند transcription (رونویسی ) و.... متفاوت است . لذا در طراحی وکتورها باید دقت شود که این وکتور بتواند حاوی یکسری ویژگیهایی باشد که با سیستمهای Replication ، Transcrption و ...ِ میزبان قابلیت تولید محصول را در نهایت داشته باشند . ) باید قطعه ژنی داخل وکتور ،دارای پروموتور قابل خواندن توسط host را باشد(
Strong and weak promoters :
همه پروموتورها ناحیه 35 -تا 10- پروموتور را دارند، اما به دلیل تفاوت در یک نوکلوتید، ممکن است Transcription efficacy متفاوتی داشته باشند یعنی سبب تفاوت در تمایل اتصال subunite سیگمای RNA پلی مراز برای اتصال به پروموتورشود و میزان Transcription (رونویسی ) را تغییر دهند پس نقش اصلی در Orginal replication توسط Promoter بازی میشود . اگر وکتوری با Orginal repletion قوی خواستیم ،از یک پروموتور ، ژنی را استخراج می کنیم که به مقدار زیاد در Sorce خود بیان می شود .
از پروموتورهای قابل خواندن در Ecoli می توان به 2 مورد زیر اشاره کرد :
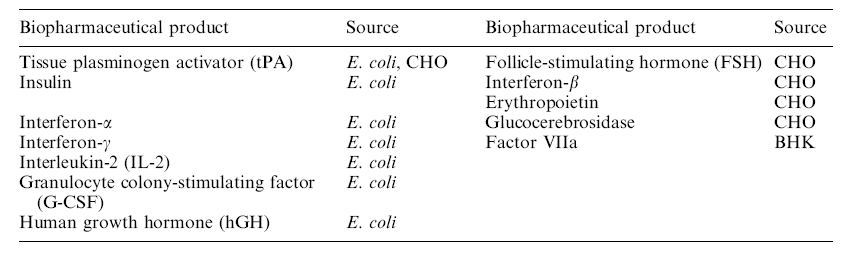
1 – lakky seo promoter
2 – T cell on promoter
Host cells سلولهای میزبان
به ترتیب اولویت :
1 – شاخصترین میزبان پروکاریوتی , Ecoli است .
2 – بعد از Ecoli باسیلوس
3 – رتبه سوم از آنِ مخمرهاست که شاخصترین آنها Saccharomyces cerevisiae
4 – قارچهایی مثل آسپرژیلوس
5 – Mamalion call line یا animal call culturاینها cell line های مختلفی اند که از Original replication های مختلف گرفته شده اند.
مثلاً در مورد سلول کبدی : دارای Cell line : PHG2 ، CHO ، BHK و ..
6 – Transgenic animals
7 – Plant – based expression system (گیاهان متنوع ) :
سیستمهایی که از آنها سلولهای گیاهی به عنوان host مطرح می شوند .
8 – Insect cell wlture system (حشرات )
مثالی از میزبانهای فوق : در جدول یکسری ترکیباتی که به صورت Recombinant (نوترکیب ) در داخل میزبانهای مختلف تهیه شده اند را مشاهده می کنید
1 - ( CHO(chinese hamster ovary cell
سلول تخمدان همستر چینی
BHK (body hamster kidney call ) -2
سلول کلیه همستر
Ecoli :
مزیتهای Ecoli برای کسب رتبه اول بین میزبانها :
1 – هزینه : این میزبان در مقادیر خیلی زیاد و با هزینه خیلی کم در سیستم فرمانتوری قابل تولید است و هم اینکه نگهداری از آنها آسان است .
2 – در مدت زمان کوتاهی می توان تعداد زیادی از آنها را داشت این ویژگی مهمی است چون اگر سرعت رشد میزبان پائین باشد سرعت تولید پروتئین هم پائین خواهد بود در نهایت بازده تولید محصول پائین می آید .
3 – معروف است :
مدت طولانی است که به عنوان Cell biologic model در بین پروکاریوتها مطرح بوده است لذا کار با آن راحت است .
4 – تولید میزان بالایی از محصول :
به راحتی دستکاری ژنتیکی می شود .می توان در آن ، سیستمهای پروموتوری را تعبیه کرد که این سیستمها ،تا 30 % کل پروتئین تولیدی در Ecoli را به خود اختصاص دهند لذا بازده تولیدی بالا می رود.
معایب سیستم Ecoli:
– LPS ( lipo poly saccaride ) موجود در cell wall آن ،توکسیک و پاتوژن است .
– عیب دوم برای همه پروکاریوتهاست . پروکاریوتها سیستم اسپلایسینگ ندارند این سیستم که دربوکاریوتها حضور دارد وظیفه اتصال قطعات اگزون به یکدیگر و دور انداختن قطعات ا ینترون را دارد . پس مجبوریم قبل از قرار دادن قطعه ژنی در وکتور ، ژن یوکاریوتی را اسپلایس کنیم ( منظور از اسپلاسینگ یکدست کردن و به هم متصل کردن است )
– Post translation modification (تغییرات پس از ترجمه ) :براساس نوع خاصی از patern (الگو) در هر سلول، این تغییرات که به صورت Acylation و اغلب glycolization (اضافه شدن الیگوساکاریدها به زنجیره پلی پپتیدی ) است رخ می دهد .
نتیجه این تغییرات روی پلی پپتید، در پروکارویوت (میزبان ) سه نتیجه را به همراه دارد :
A : تغییر در خصوصیات فارماکوکینتیک یک پروتئین ( مدت زمان ماندن محصول در بدن و زمان کلیرانس از بدن )
B : اثر روی biological activity پروتئین حاصل : که یا اثر آنرا کم می کند یا اصلاً اجازه نمی دهد محصول اثرگذار باشد از طرفی برای فعالیت برخی از پروتئینها حتماً لازم است مرحله گلیکو لیزاسیون رخ دهد اما متاسفانه طبق الگویی که دریوکاریوتها هست رخ نمی دهد .
C– برخی از پروتئینها برای اثرگذاری دریوکاربوتها لازم نیست که حتماً گلیکولیزه شوند و اگر هم شوند چندان شایان اهمیت نیست مثل 2IL
از موارد A ،B و C نتیجه می گیریم که : ژنی را در Ecoli کلون می کنیم که با گلیکولیزه شدن توسط الگوی پروکاریوتی Ecoli خواص فعالیت بیولوژیکی آن تغییر نکند .
– اکثر پروتئینهای ساخته شده در سیستم Ecoli درون سلولی اند : اگر پروتئین به بیرون ترشح می شد استخراج آن راحتر بود. وقتی پروتئین داخل سلولی باشد درطی Purification ( خالص سازی )، یک مرحله اضافی تر خواهیم داشت چون باید Ecoli را بشکنیم بعد با سانترفیوژهای قوی، پروتئین های داخلش را جدا کنیم لذا خالص سازی سخت تر خواهد شد .
– ساختار سوم پروتئینها تعیین کننده Activity و biological آن است .
این ساختار با تشکیل باند دی سولفیدی S- S بین اسید آینه های گوگرددار مثل سیستئین حاصل می شود که تاخوردگی نهایی پروتئین ( Protein folding) را مشخص می کند متاسفانه در سیستم Ecoli , Protein folding به طورغیر مناسب وجود دارد اما برای فعالیت اکثر پروتئین ها کافی است.
– aggrigation : از نکات مثبت سیستم Ecoli , اختصاص یافتن 30 % کل پروتئین تولیدی، به پروتئینهای ژن خارجی بود . وقتی بار اضافی را به میزبان تحمیل کنیم یعنی مجبورش کنیم که تند تند پروتئین بسازد،همان سیستم folding ضعیف Partial folding )) هم به درستی انجام نمی دهد .
وقتی که یک پروتئین ساختار سوم را به خود می گیرد چون در محیط مایی سیتوپلاسم هست بخش های هیدروفوبی را در داخل وهیدروفیلی را در خارج قرار می دهد و بر این اساس fold می شود .
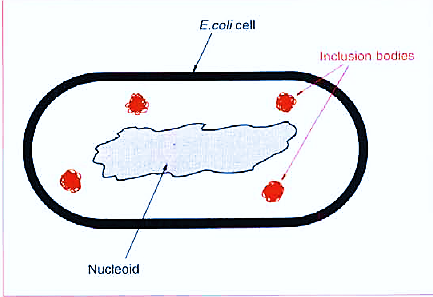
اما وقتی سیستم folding ضعیف کارکند و قسمت هیدروفوبی را خارج قرار می دهد لذا تداخلات غیر هیدروفونی بین مولکولها ی پروتئین و سیتوپلاسم رخ داده و پروتئینها به هم متصل شده (اگریگه) تولید inclusion body را می کند
Inclogen bodies:
1 - وقتی پروتئین درون سلولی باشد احتمال تشکیل inclogen bodies هم بیشتر خواهد شد .
2 - مزیت تشکیل inclogen body این است چون دانسیته بیشتری نسبت به سایر اجزای pro داخل Ecoli دارند با سانترفیوژ راحت قابل خالص سازی هستند .
3- پس از خالص سازی ، پروتئین به فرم فعال نیست (راه حل: denaturation یعنی تاخوردگی ها (fold ) را باز کنیم{ساختار سه بعدی را بشکنیم } و مجدداً refold کنیم تا نقاط فعالی که پنهان شده بودند نمایان شوند.)
معایب:
پر هزینه است و ممکن است پروتئینها کاملاً refold نشوند و active site مناسب را پیدا نکنند . راه حل : کلاً از تشکیل in clogene body جلوگیری کنیم به کمک :
1 – بیان کردن ژن در دمای پائینتر از 37 c ( یعنی 30 ): با این کارواکنشهای متابولیکی کندتر شده لذا زمان بیشتر صرف folding
بیشتر و بهتر پروتئین می شود.
2 – استفاده از سویه های Ecoli که مهندسی ژنتیک شده اند و مقادیر زیادی از chaperon protein را در خود تولید می کنند .
پروتئینهای چپرونی وظیفه هدایت پروتئینهای ما را به سوی folding صحیح را دارند تافرم فضایی سوم مناسب را به خود بگیرند
Mamalian cells: (سلول پستانداران )
2 دسته ی پرکاربرد از این سیستم :
1 – CHO
2 – BHK
مزیت :
1- داشتن سیستم اسپلایسینگ
2-ا نجام post transitional modification مطابق با الگوی یوکارپوتی چون پروتئین حاصل از ژن در hust یوکارپوتی تولید میشود لذا گلیکولیزه شدن را مطابق الگوی یوکاریوتی انجام می دهد پس پروتئین دارای Active sites و Biological activit مناسب خواهد بود .
Note( – اگر هدف ما تولید پروتئینی با خواص فارموکوکینتیک مناسب است بهتر است host انتخابی از Mamaliane cell ها باشد
معایب :
1– پیچیده بودن و پر هزینه بودن محیط کشت برای این رده از میزبانها
2 – کند بودن سرعت رشد
3 – نتیجه سرعت کم طولانی تر شدن مدت زمان نگهداری برای تولید پروتئین
4 – حساس بودن به Physical damages (صدمات فیزیکی ) به علت نداشتن cell wall
(مخمرها) : Yeast
نوع پر کاربرد این سیستم : ساکارومیسزسرویزیه
مزیت :
1 – سیستم بیولوژیک و ژنتیکی شناخته شده دارند چون از دیرباز در صنعت تخمیر، ناخودآگاه یا آگاهانه در تهیه پنیر و نان و ... استفاده می شدند .
2 – سیستمهای فرمانتوری شناخته شده دارند ومی توانیم در مقادیر بالا آنها را رشد دهیم و محصول بگیریم .
3 – کم هزینه بودن محیط کشت ( مثل Ecoli )
4 – بالا بودن سرعت رشد ( برخلاف Mamalian cell )
5 – چون جزء یوکاریوتها هستند لذا post transmition modification دارد ( برخلاف Ecoli ) اما patern گلیگولیزه کردن آن با Mamalian cell فرق دارد .
معایب :
1 – متفاوت بودن الگوی posttransmition madification با الگوی لازم
2 – پائین بودن efficacy بیان پروتئین ( در Ecoli از 100 % ، 30 % پروتئینها را پروتیین مد نظر بودند اما در مخمرها 5 % هست )
قارچها fungies
مزیت :
1 – تهیه آلفا آمیلاز یا گلوکوآمیلاز
2 – دارای post transmition modification است.
3 – به علت استفاده دیرینه از آنها بسیار شناخته شده اند .
4 –تولید انبوه در فرمانتورها
5 – تولید پروتئین به صورت extra cellular ï راحت و کم هزینه بودن خالص سازی و سبکتر بودن down stream
دفتر مرکزی
کرج - بعد از پل آزادگان - ابتدای خیابان مطهری- نبش کوچه ساوجی - ساختمان کوروش پلاک 901 - طبقه اول واحد 1- کد پستی: 3149649837
تلفن های تماس
026-32555937 - 026-32555938
09363928058 - 09123050747
09120796671 - 09380626117
asadimohammadreza@yahoo.com
kalantari.ali67@gmail.com
.png)